EDQM检查和缺陷趋势概述(2006-2018)
发布日期:2019-05-12
EDQM已于2019年5月9日公布了《EDQM检查和缺陷趋势概述(2006-2018)》(PA/PH/CEP(18)56, 2019年4月)。
该文件是对EDQM自2006年至2018年执行的原料药(API)检查数据的回顾。该文件总结了EDQM执行欧盟GMP检查及相应CEP文档检查期间发现缺陷的趋势。
在EDQM检测期间发现的缺陷通常参考了欧盟GMP第二部分及相应附录,及参考了相应的CEP文档和欧洲药典(Ph.Eur.)。
该文件的主要内容如下:
1. 检查地点、历史和结果回顾
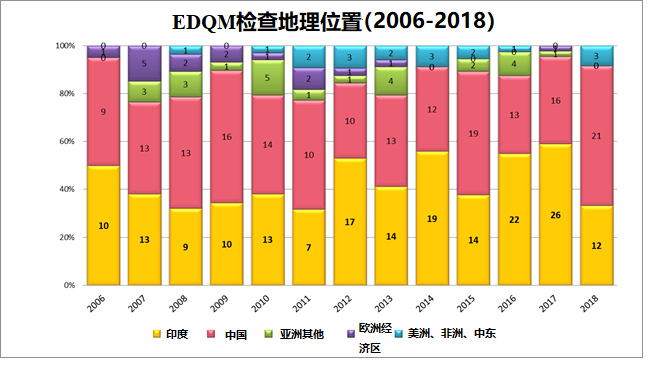
1.1 EDQM检查场地的地理位置分布如下图:
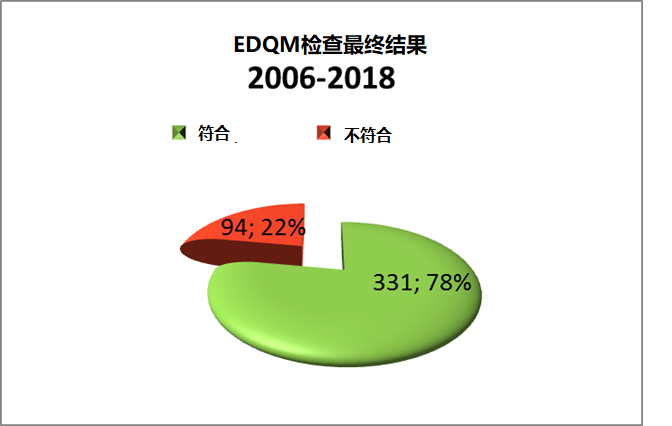
1.2 EDQM检查结果分布如下图:

下图显示在回顾期间的EDQM检查结果总数和比例:
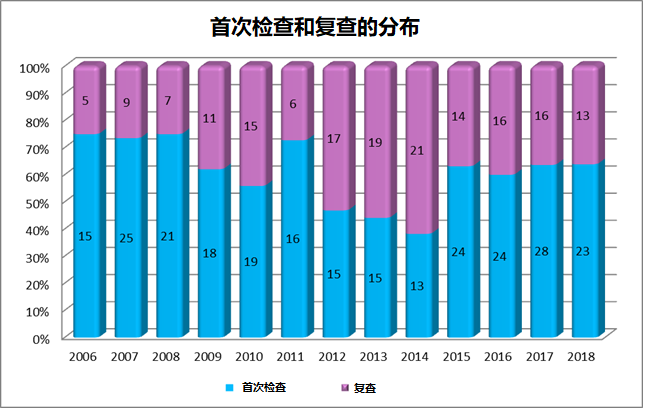
1.3 EDQM检查(首次检查或复查)分布见下表:
2. GMP缺陷(包括CEP符合性)分布及关键程度
根据EDQM检查期间报告的缺陷对公众健康风险及对欧盟GMP、相应CEP文档和欧洲药典(Ph.Eur.)的偏离程度,缺陷分为关键缺陷、主要缺陷及其它缺陷。
本次回顾中,已根据欧盟GMP第二部分相关章节、CEP文档符合性和欧洲药典,对缺陷进行整理。一些项目按欧盟GMP第二部分章节进行分组。一个项目收集了所有CEP文档和欧洲药典问题。分组的目的是避免一些缺陷可以关联不同的章节的情况的不确定性。
在图中,每组只有欧盟GMP第二部分章节的编号被提及。
2.1 在2006年至2018年EDQM的GMP和CEP检查缺陷整体分布如下图:

2.2 下图显示了这些年GMP和CEP符合性缺陷的趋势(每年缺陷总数百分数):
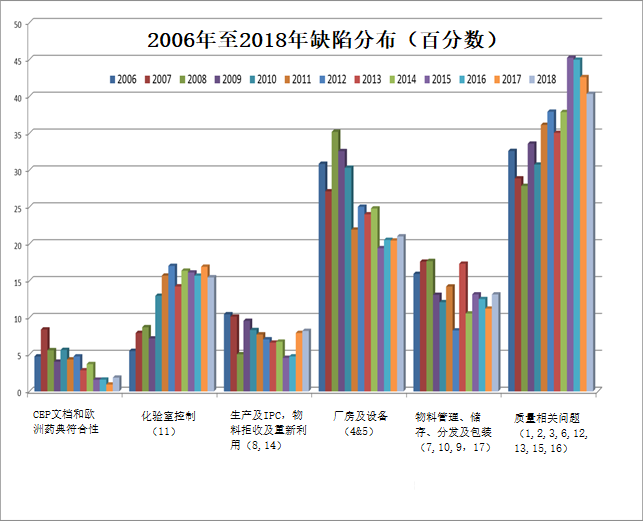
从图中可以看到如下趋势:
质量相关问题:至2015年全面增加(从2006年的32%增加至45%),然后轻微下降(在2018年下降至40%);
物料管理:前期是变化的,自2014年起趋于稳定(10-13%);
厂房及设备:从2008年(35%)起减少,至2015年趋于稳定(19-21%);
生产:至2016年一直减少,在2017年至2018年增加(从5%增至8%);
化验室控制:至2012年一直增加(17%),然后趋于稳定;
CEP文档和欧洲药典符合性:有规律地减少(从2007年的8%下降至2018年的1%)。
2.3 对近期检查(2017-2018)的每个GMP领域各级缺陷(关键、重大、其它)数量进行了分析并在下图中进行了阐述:
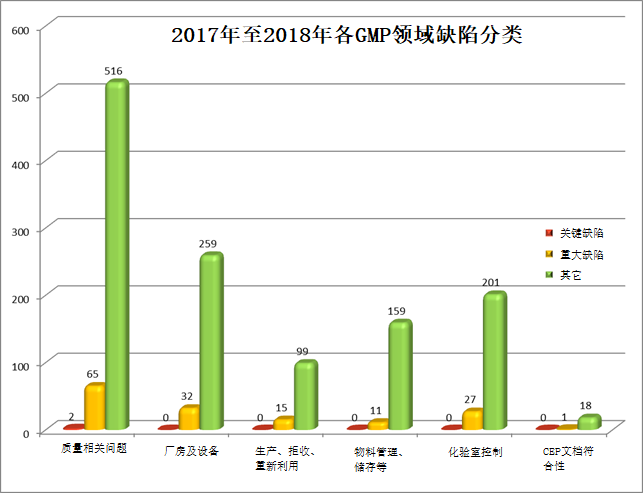
从图中可以看到,重大和关键缺陷最易发生在质量相关问题,然后是厂房及设备,化验室控制排第三位(详见第3部分)。
应指出的是重大缺陷的合并可以导致对公众健康的全面关键风险(因此不符合检查结果没有单独的关键缺陷),这种情况没有反映在图中。
3. GMP缺陷最常见类别
在2006至2018年EDQM检查期间识别出的各GMP领域最常见缺陷类别如下:
3.1 质量相关问题
质量体系不完善或无效,导致操作不可靠,证据如下:
质量部门对GMP活动监管不充分,例如:
n 没有有效地控制文件(包括纸质文件和电子文件);
n 生产和化验室活动概述不全面;
n 对质量事件(投诉、偏差、OOS结果、变更控制)不报告和或调查不全面。
欺骗性文件行为,例如:
n 为了证明可接受的期盼的结果、数值或日期,重写文件;
n 操作没有及时被记录;
n 没有记录;
n 采用活页替代规定的日志;
质量风险管理原则在如生产活动、偏差、变更控制等方面没有运用或实施不充分。
年度质量回顾没有被公司作为质量工具,例如:
n 没有反映所有批次(特别是“非CEP”级,甚至采用相同工艺生产的那些批次);
n 趋势没有被发现或调查;
不充分的人员培训,例如:
n 没有对高层管理人员提供GMP相关方面的培训;
n 没有评估培训的有效性或评估价值有限;
不充分的验证,例如:
n 没有对回收溶剂的利用、混合或微粉化工艺进行说明;
n 缺乏清洁验证不同方法的充足知识。
3.2 物料管理
对关键起始物料或中间体的供应商的批准和管理不充分(例如:不可靠的现场审计);
因容器识别不充分导致可追溯性缺失的风险;
不恰当的贮存条件(温度、湿度、非受控储存设施)。
3.3 厂房及设备
来源于下述情况导致的污染和交叉污染风险:
n 不恰当的设施设计;
n 不充分的设备清洁;
n 不充足的设备维护。
缺乏与设备确认相关的适当的用户需求标准;
缺乏用于物料管理、生产、化验室控制等计算机化系统管理的充足科学方法,例如:
n 缺乏适当的用户需求标准;
n 对验证要求的知识不充分;
n 没有对导致可追溯性缺失风险的准入层级管理或不充分;
n 对预防数据处理的控制不充分;
n 没有审计追踪或审核不充分;
n IT 人员缺乏或没有GMP知识。
3.4 生产
在混合前,没有对批进行适当的检测;
没有对溶剂回收进行控制。
3.5 化验室控制
检测活动方面的欺骗性行为,例如:
n 预测试或“测试至符合为止”;
n 删除OOS结果;
n 分析结果不可靠。
不可靠的微生物结果;
化学对照品(CRS)问题:
n 没有采用欧洲药典CRS;
n 工作对照品建立不完善。
对饮用水缺乏适当的监控。
3.6 委托活动
对一些活动没有审核和接受,或不充分(例如:设备/仪器校验、计算机化系统验证、后续粉末加工)
3.7 关于数据完整性缺陷的特殊情况
常见数据完整性违背发生在文件处理和化验室控制,也发现其它问题,例如对计算机化系统的验证和控制缺失或存在差距。
在2015至2018年期间发现的44%的关键缺陷和25%的重大缺陷是关于数据完整性问题。
更多详情,请参考EDQM官网上的原始文件https://www.edqm.eu/en/news/edqm-inspections-and-trends-gmp-deficiencies-overview-2006-2018-paphcep18-56-april-2019。
佛山市瑞通认证咨询有限公司
中国广东省佛山市南海区黄岐广佛1路富威大厦803室
Tel.: +86-136 6005 7841, +86-13695153512
E-mail: ruitong01@gdruitong.cn


